(通讯员 陈敏)近日,五楼自拍
动物科学技术学院、动物医学院谢书宇教授和陈冬梅教授团队在《Cell Reports》发表了题为“Aryl hydrocarbon receptor-induced activation of AIM2 inflammasome is mediated by MOMP and MPT: A vital therapeutic pathway for inflammation”的研究论文。
炎症是机体应对损伤或感染的重要防御反应,但持续或过度的炎症是许多慢性疾病(如自身免疫病、代谢性疾病、神经退行性疾病等)的共同病理基础。线粒体作为细胞的能量工厂和信号枢纽,其功能障碍会释放包括线粒体DNA(mtDNA)在内的损伤相关分子模式(DAMPs),驱动炎症反应。芳香烃受体(AHR)是一种配体激活的转录因子,广泛参与免疫与炎症调控,但其在连接环境刺激、线粒体损伤与炎症信号放大中的具体机制尚不明确。全氟及多氟烷基物质(PFAS)是一类性质稳定、难降解的环境持久性有机污染物,在环境和生物体内广泛存在。PFAS暴露与多种器官的炎症损伤密切相关,但其诱发炎症的原始靶点和精确信号通路仍有待揭示。
本研究以典型PFAS化合物8:2氟调醇(8:2 FTOH)为主要研究对象,结合多种AHR配体,综合运用代谢组学、分子生物学、细胞生物学及动物模型等技术手段,首次证实线性烷烃结构的PFAS可直接结合并激活AHR,阐明其诱发炎症的起始机制。AHR激活后通过转录依赖与非依赖双重途径诱导线粒体损伤:一方面,AHR与配体结合破坏其与线粒体内膜ATP合酶的相互作用,导致能量代谢紊乱;另一方面,AHR作为转录因子上调促凋亡蛋白BAX/BAK表达,共同引发线粒体外膜通透(MOMP)与线粒体通透性转换(MPT),致使mtDNA泄漏至细胞质。泄漏的mtDNA被胞质模式识别受体AIM2识别,激活AIM2炎症小体,驱动caspase-1切割、GSDMD成孔及IL-1β/IL-18等促炎因子释放,最终导致细胞焦亡与炎症反应。通过在细胞与动物模型中抑制AHR或AIM2,能有效阻断上述损伤与炎症通路,显著减轻组织炎症反应,确立了“AHR–AIM2”信号轴作为应对PFAS致炎的潜在治疗靶点。
该研究首次系统阐明了PFAS通过激活AHR,诱导线粒体膜通透性改变,导致线粒体DNA泄漏,进而激活AIM2炎症小体引发细胞焦亡和炎症反应的全新分子机制。该发现不仅揭示了AHR作为DAMPs信号枢纽的关键作用,也为PFAS诱发的炎症性疾病及多种炎症相关疾病的治疗提供了新的潜在靶点和干预策略。
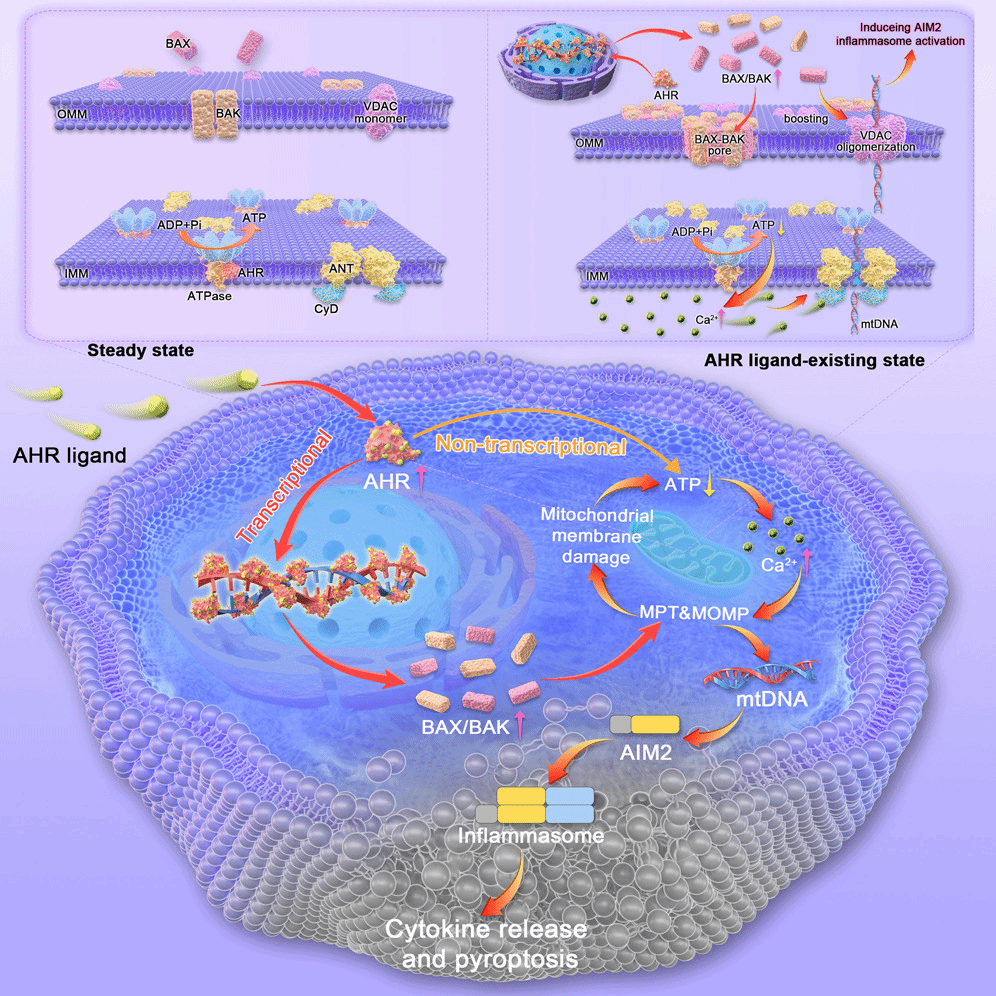
AHR通过诱导线粒体损伤与mtDNA泄漏激活AIM2炎症小体驱动细胞焦亡
华中农业大学博士研究生陈敏为论文的独立一作,陈冬梅教授和谢书宇教授为论文共同通讯。该研究获得国家重点研发计划(2022YFD130070)和中央高校基本科研业务费(2662023DKPY004)的大力资助。
网址连接://doi.org/10.1016/j.celrep.2025.116673
审核:谢书宇

